Zahlen und Fakten
Die Apotheken melden in großer Zahl Verdachtsfälle von unerwünschten Arzneimittelwirkungen und pharmazeutischen Qualitätsmängeln an die Geschäftsstelle der AMK. Die Meldestatistik aus Apotheken wird jährlich ausgewertet und veröffentlicht.
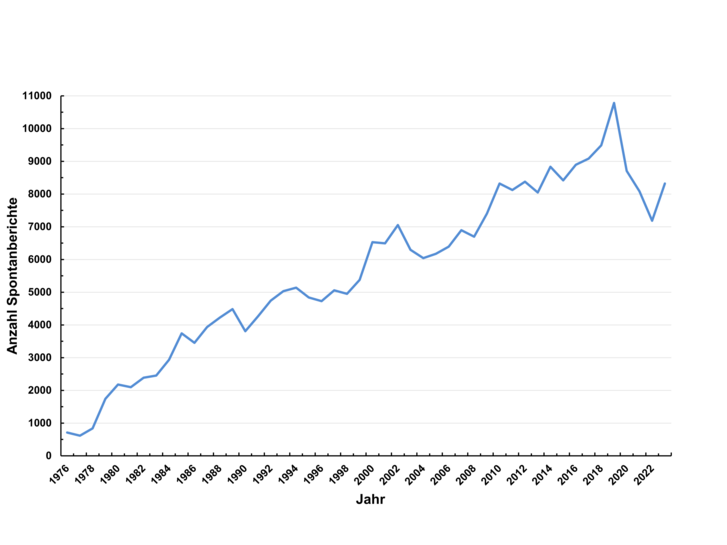
Der Verlauf der jährlichen Berichtszahl ist über mehrere Jahrzehnte linear ansteigend. Daher kann von einem konstanten, jährlichen Zuwachs an Berichten ausgegangen werden. Stetig zunehmende Berichtszahlen werden auch von anderen nationalen und internationalen Sammelstellen für Spontanberichte beobachtet. Eine Abnahme der Spontanberichte konnte mit dem Ausbruch der SARS-CoV-2-Pandemie beobachtet werden.
Im Jahr 2023 erhielt die AMK-Geschäftsstelle insgesamt 8.320 Spontanberichte zu Verdachtsfällen zu Qualitätsmängeln und unerwünschten Wirkungen von Arzneimitteln (siehe Abbildung 1) aus 4.385 verschiedenen (Krankenhaus‑)Apotheken (1).
Nach drei Jahren der Corona-Pandemie mit jeweils rückläufigen Berichtszahlen meldeten somit wieder mehr Apothekerinnen und Apotheker auch mehr Arzneimittelrisiken. Insgesamt steigerte sich die Anzahl an Meldungen um über 1.100 Meldungen gegenüber dem Vorjahr und auch die Anzahl meldender Apotheken stieg um 336.
Insgesamt betrafen 96,8 Prozent aller Meldungen Arzneimittel: 6.781 verschreibungspflichtige Arzneimittel inkl. 279 Betäubungsmittel und 1.273 nicht verschreibungspflichtige Arzneimittel. 236 Meldungen bezogen sich auf Lebensmittel inklusive Nahrungsergänzungsmittel, Drogen und Chemikalien sowie weitere Produkte.
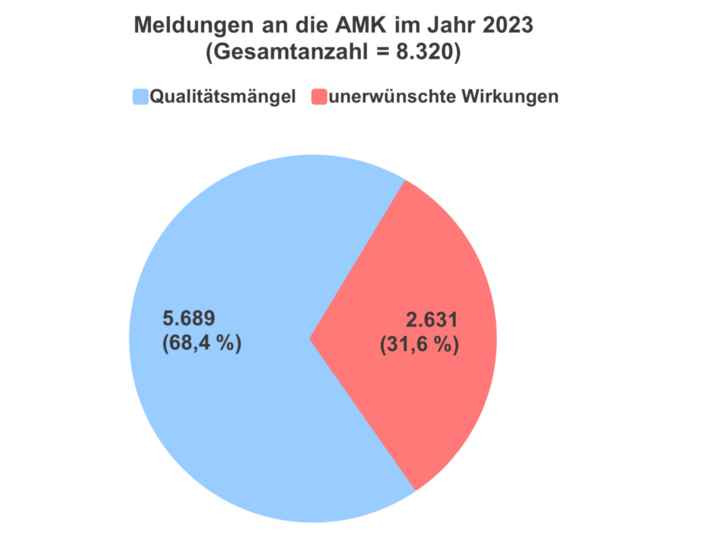
Die Anzahl der Spontanberichte zu unerwünschten Wirkungen stieg im Vergleich zum Vorjahr um 292 auf insgesamt 2.631 (siehe Tabelle 1). Hierunter fanden sich 730 Meldungen, die aufgrund der Schwere der beschriebenen Nebenwirkung innerhalb von 15 Tagen an die zuständigen Bundesoberbehörden weitergeleitet wurden (2). Meldungen zu unerwünschten Wirkungen machten einen Anteil von 31,6 Prozent aller eingegangenen Spontanberichte aus. Etwa sechs Prozent (163 Meldungen) aller Nebenwirkungsmeldungen bezogen sich auf eine Arzneimittelsubstitution.
Die Anzahl an Medikationsfehlermeldungen stieg im Vergleich zum Vorjahr (2023: 247, 2022: 153). Ihr Anteil an den Meldungen zu unerwünschten Wirkungen stieg ebenfalls von 6,5 auf 9,4 Prozent. Weiterhin erfasste die AMK mehr Verdachtsmeldungen zu Arzneimittelmissbrauch (2023: 35, 2022: 27).
Unter den berichteten Verdachtsmeldungen zu Qualitätsmängeln (5.689 Meldungen) wurden, wie in den Jahren zuvor, am häufigsten Verpackungsfehler gemeldet, gefolgt von mechanischen Defekten, galenischen Mängeln und Deklarationsmängeln (siehe Tabelle 2). Zu vermuteten Manipulationen bzw. Fälschungen gingen insgesamt 15 Meldungen im Jahr 2023 ein.
Die AMK erhielt mit 462 Einsendungen erneut weniger Reklamationsmuster (2022: 527, 2021: 739). Bei rund acht Prozent aller eingesandten Muster wurde eine Untersuchung im Zentrallaboratorium Deutscher Apotheker e. V. veranlasst. Etwa jede dritte Laboruntersuchung (32 Prozent) bestätigte den Verdachtsfall. Demgegenüber hat sich die Zahl an zugesandten Fotos/Bilddokumentationen an die AMK nahezu verdoppelt (2023: 2.638, 2022: 1.362); d. h. rund 32 Prozent aller Meldungen enthielten zusätzliches Bildmaterial. Dies kann auf eine neue Funktionalität der Webformulare zurückgeführt werden. Seit September 2022 können einer Onlinemeldung einfach und direkt zweckdienliche Begleitdokumente beigefügt werden (3).
Die AMK veröffentlichte im Jahr 2023 insgesamt 294 Risikoinformationen; hierunter 52 Rote-Hand- und Informationsbriefe, 14 Informationen der AMK sowie 46 weitere Nachrichten zu Risiken von Arzneimitteln oder anderen Produkten, die von Behörden, Herstellern und relevanten Institutionen veröffentlicht wurden.
Zudem wurden 152 Chargenrückrufe, 5 Chargenüberprüfungen sowie 22 Rückrufe über die AMK bekanntgegeben.
Die Apotheken leisteten im Jahr 2023 einen unverzichtbaren Beitrag zur Erhöhung der Arzneimittel(therapie)sicherheit und damit für die Patientensicherheit. Insgesamt 26 AMK-Nachrichten beruhten auf 138 Meldungen aus 128 Apotheken. Weitere 353 Spontanberichte aus 331 Apotheken führten zur Einleitung korrektiver, risikominimierender Maßnahmen beim betroffenen Hersteller.
Die AMK bedankt sich für das Engagement der Apothekerinnen und Apotheker und bittet darum, Verdachtsfälle von Nebenwirkungen und Qualitätsmängeln von Arzneimitteln vorzugsweise online unter www.arzneimittelkommission.de zu melden.
Tabelle 1: Anzahl der Verdachtsmeldungen zu Nebenwirkungen (Arzneimittel und andere Produktgruppen), Medikationsfehlern und Missbrauch an die AMK im Jahr 2023
| Kategorie der Verdachtsmeldung | Anzahl | Anteil in Prozent |
|---|---|---|
| Meldungen zu unerwünschten Wirkungen (Verdachtsfälle), gesamt | 2.631 | 100,0 |
| Nebenwirkungen (Fertigarzneimittel) | 2.299 | 87,4 |
| Medikationsfehler | 242 | 9,2 |
| Missbrauch | 34 | 1,3 |
| Meldungen zu unerwünschten Wirkungen bei anderen Produktgruppen | 56 | 2,1 |
Tabelle 2: Anzahl der Verdachtsmeldungen zu Qualitätsmängeln (Arzneimittel und andere Produktgruppen) an die AMK im Jahr 2023
| Kategorie der Verdachtsmeldung | Anzahl | Anteil in Prozent |
|---|---|---|
| Meldungen zu Qualitätsmängeln (Verdachtsfälle), gesamt | 5.689 | 100,0 |
| Verpackungsfehler | 2.779 | 48,9 |
| Mechanische Defekte | 1.220 | 21,4 |
| Galenische Mängel | 1.038 | 18,2 |
| Deklarationsmängel | 428 | 7,5 |
| Minderwirkung (mit Verdacht auf Qualitätsmangel) | 164 | 2,9 |
| Manipulation bzw. Fälschung | 15 | 0,3 |
| Sonstige Mängel | 45 | 0,8 |
Im Jahr 2022 erhielt die AMK-Geschäftsstelle insgesamt 7.182 Spontanberichte zu vermuteten Qualitätsmängeln und unerwünschten Wirkungen von Arzneimitteln (siehe Abbildung 1) aus 4.049 verschiedenen (Krankenhaus-)Apotheken. Somit setzt sich die Abnahme der Meldetätigkeit seit Beginn der SARS-CoV-2-Pandemie fort (2021: 8.082; 2020: 8.707).
Die AMK hat die Apothekerinnen und Apotheker bereits mittels Umfrage zu den Gründen des Melderückgangs befragt (siehe Pharm. Ztg. Nr. 8, Seite 24-25). Etwa 17 Prozent bestätigten, aufgrund konkreter (Mehr-)Belastungen während der Pandemie weniger Arzneimittelrisiken an die AMK gemeldet zu haben. Weitere sechs Prozent gaben an, dass sich die Patientenkontakte verringert hätten und so auch weniger Arzneimittelrisiken identifiziert beziehungsweise berichtet wurden. Damit bestätigt sich, dass das Pandemiegeschehen einen Einfluss auf die Meldebereitschaft in Apotheken (gehabt) hat.
Insgesamt betrafen 96,4 Prozent aller Meldungen im Jahr 2022 Arzneimittel: 5.796 verschreibungspflichtige Arzneimittel inkl. 239 Betäubungsmittel und 1.126 nicht verschreibungspflichtige Arzneimittel. Weitere 260 Meldungen bezogen sich auf Lebensmittel inkl. Nahrungsergänzungsmittel, Drogen und Chemikalien sowie weitere Produkte.
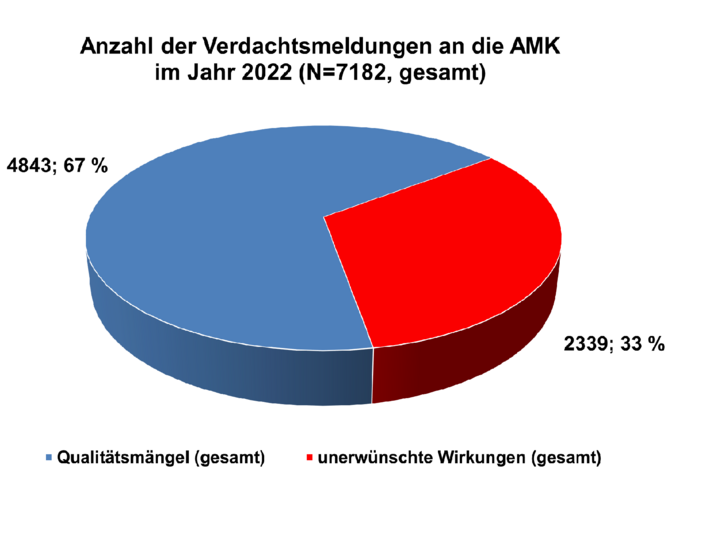
Die Anzahl der Spontanberichte zu unerwünschten Wirkungen sank im Vergleich zum Vorjahr um 209 auf insgesamt 2.339 ab (siehe Tabelle 1). Hierunter fanden sich 680 Meldungen (inklusive Folgeinformationen) zu unerwünschten Arzneimittelwirkungen (UAW), die aufgrund ihrer Klassifikation der Art oder Schwere innerhalb von 15 Tagen (ICH-Guideline E2D) an die zuständigen Bundesoberbehörden weitergeleitet wurden. Meldungen zu UAW machten, ähnlich den Vorjahren, einen Anteil von etwa 32,6 Prozent aller eingegangenen Berichte aus. Etwa 4 Prozent (91 Meldungen) aller Nebenwirkungsmeldungen bezogen sich auf eine Arzneimittelsubstitution.
Die Anzahl an Medikationsfehlermeldungen blieb mit 153 blieb annähernd gleich (2021: 149). Ihr Anteil innerhalb der UAW-Meldungen stieg jedoch von 5,6 auf 6,5 Prozent. Weiterhin wurden weniger Verdachtsmeldungen zu Arzneimittelmissbrauch erfasst (2022: 27, 2021: 35).
Unter den berichteten Verdachtsmeldungen zu Qualitätsmängeln (4.843 Meldungen) wurden, wie in den Jahren zuvor, am häufigsten Verpackungsfehler gemeldet, gefolgt von mechanischen Defekten, galenischen Mängeln und Deklarationsmängeln (siehe Tabelle 2). Auch erhielt die AMK-Geschäftsstelle ähnlich viele Berichte zu vermuteten Manipulationen bzw. Fälschungen wie im Vorjahr (2022: 11, 2021: 16).
Die AMK-Geschäftsstelle erhielt im Jahr 2022 mit insgesamt 527 Einsendungen erneut weniger Reklamationsmuster (2021: 739, 2020: 1.047). Die Zahl an zugesandten Bilddokumentationen stieg dagegen auf 1.362 (2021: 1.103). Bei rund 8 Prozent aller eingesandten Muster wurde eine Untersuchung im Zentrallaboratorium Deutscher Apotheker e. V. veranlasst. In 25 Prozent dieser Laboruntersuchungen konnte ein Verdachtsfall bestätigt werden.
Die AMK veröffentlichte im Jahr 2022 insgesamt 274 Risikoinformationen; hierunter 42 Rote-Hand- und Informationsbriefe, 19 Informationen der AMK sowie 29 weitere Nachrichten zu Risiken von Arzneimitteln oder anderen Produkten, die von Behörden, Herstellern und relevanten Institutionen veröffentlicht wurden.
Zudem wurden 151 Chargenrückrufe, 3 Chargenüberprüfungen sowie 18 Rückrufe über die AMK bekanntgegeben.
Insgesamt 24 AMK-Nachrichten beruhten auf 53 Meldungen aus 52 Apotheken. Weitere 314 Spontanberichte aus 300 Apotheken führten zur Einleitung korrektiver, risikominimierender Maßnahmen beim betroffenen Hersteller. Somit leisteten die Apotheken erneut einen unverzichtbaren Beitrag zur Erhöhung der Arzneimittel(therapie)sicherheit und damit der Patientensicherheit.
Tabelle 1: Anzahl der Verdachtsmeldungen zu unerwünschten Wirkungen (Arzneimittel, andere Produktgruppen), Medikationsfehlern und Missbrauch an die AMK im Jahr 2022
| Kategorie der Verdachtsmeldung | Anzahl | Anteil in Prozent |
|---|---|---|
| Meldungen zu unerwünschten Wirkungen (Verdachtsfälle), gesamt | 2.339 | 100,0 |
| Unerwünschte Wirkungen, die Arzneimittel betrafen | 2.097 | 89,7 |
| Unerwünschte Wirkungen, die nicht Arzneimittel, sondern andere Produktgruppen betrafen | 62 | 2,6 |
| Medikationsfehler | 153 | 6,5 |
| Missbrauch | 27 | 1,2 |
Tabelle 2: Anzahl der Verdachtsmeldungen zu Qualitätsmängeln an die AMK im Jahr 2022
| Kategorie der Verdachtsmeldung | Anzahl | Anteil in Prozent |
|---|---|---|
| Meldungen zu Qualitätsmängeln (Verdachtsfälle), gesamt | 4.843 | 100,0 |
| Verpackungsfehler | 2.180 | 45,0 |
| Mechanische Defekte | 1.101 | 22,7 |
| Galenische Mängel | 1.010 | 20,9 |
| Deklarationsmängel | 368 | 7,6 |
| Minderwirkung (mit Verdacht auf Qualitätsmangel) | 80 | 1,7 |
| Manipulation bzw. Fälschung | 11 | 0,2 |
| Sonstige Mängel | 93 | 1,9 |
Im Jahr 2021 erhielt die AMK-Geschäftsstelle 8.082 Spontanberichte zu vermuteten Qualitätsmängeln und unerwünschten Wirkungen von Arzneimitteln (Abbildung 1); diese Zahl ist niedriger als im Vorjahr. Die Meldungen stammen aus 4.268 verschiedenen (Krankenhaus-)Apotheken.
Insgesamt betrafen knapp 95 Prozent aller Meldungen Arzneimittel: 6.579 verschreibungspflichtige (inkl. 237 Betäubungsmittel) und 1.084 nicht verschreibungspflichtige Arzneimittel. Weitere 419 Meldungen bezogen sich auf Lebensmittel inkl. Nahrungsergänzungsmittel, Chemikalien und weitere Produkte.
ApothekerInnen waren im vergangenen Jahr besonders gefordert, als essenzieller Teil der nationalen Impfsurveillance, unerwünschte Arzneimittelwirkungen (UAW) zu erfragen, die im Zusammenhang mit der Anwendung der COVID-19-Impfstoffe aufgetreten sind. Die AMK erhielt im Jahr 2021 insgesamt 990 Verdachtsmeldungen von Arzneimittelrisiken zu den mRNA-Impfstoffen Comirnaty® und Spikevax® sowie den Vektor-Impfstoffen Vaxzevria® und COVID-19 Vaccine Janssen®. 764 Meldungen bezogen sich auf UAW; 483 davon wurden als schwerwiegend klassifiziert.
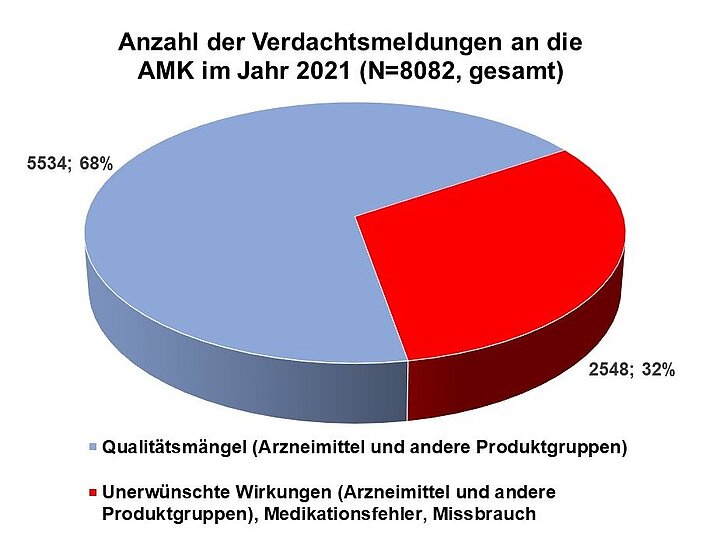
Insgesamt stieg die Anzahl der Spontanberichte zu UAW im Vergleich zum Vorjahr um 177 auf 2.548 (Tabelle 1); dies entspricht knapp 32 Prozent aller Meldungen. Etwa fünf Prozent (111 Meldungen) aller Nebenwirkungsmeldungen bezogen sich auf eine Arzneimittelsubstitution wie aut idem bzw. aut simile.
Die Anzahl an Meldungen zu Medikationsfehlern sank leicht auf 149 (2020: 184) und auch ihr Anteil an den UAW-Meldungen reduzierte sich von 7,7 Prozent im Vorjahr auf 5,9 Prozent. Ebenso wurden weniger Verdachtsmeldungen zu Arzneimittelmissbrauch berichtet (2021: 35; 2020: 56).
Unter den 5.534 Verdachtsmeldungen zu Qualitätsmängeln wurden am häufigsten Verpackungsfehler gemeldet, gefolgt von mechanischen Defekten, galenischen Mängeln und Deklarationsmängeln (Tabelle 2). Im Jahr 2021 erhielt die AMK-Geschäftsstelle 16 Meldungen zu vermuteten Manipulationen bzw. Fälschungen (2020: 10).
Die AMK-Geschäftsstelle erhielt im Jahr 2021 mit insgesamt 739 Einsendungen weniger Reklamationsmuster als 2020 (1.047). Bei rund 14 Prozent der eingesandten Muster wurde eine Untersuchung im Zentrallaboratorium Deutscher Apotheker e. V. veranlasst. In 19 Prozent dieser Laboruntersuchungen konnte ein Verdachtsfall bestätigt werden.
Die AMK veröffentlichte im Jahr 2021 insgesamt 282 Nachrichten; hierunter 38 Rote-Hand- und Informationsbriefe, 12 Informationen der AMK sowie 29 weitere Nachrichten zu Risiken von Arzneimitteln oder anderen Produkten, die von Behörden, Herstellern und relevanten Institutionen veröffentlicht wurden. Zudem wurden 179 Chargenrückrufe, fünf Chargenüberprüfungen sowie 19 Rückrufe über die AMK bekanntgegeben.
Insgesamt 25 AMK-Nachrichten beruhten auf 80 Meldungen aus 74 Apotheken. Weitere 478 Spontanberichte aus 438 Apotheken führten zur Einleitung korrektiver, risikominimierender Maßnahmen beim betroffenen Hersteller. Somit leisteten die Apotheken – auch in der anhaltenden SARS-CoV-2-Pandemie – einen unverzichtbaren Beitrag zur Erhöhung der Arzneimittel(therapie)sicherheit und damit der Patientensicherheit.
Tabelle 1: Anzahl der Verdachtsmeldungen zu unerwünschten Wirkungen, Medikationsfehlern und Missbrauch an die AMK im Jahr 2021
| Kategorie der Verdachtsmeldung | Anzahl | Anteil in Prozent |
|---|---|---|
| Meldungen zu unerwünschten Wirkungen (Verdachtsfälle), gesamt | 2.548 | 100,0 |
| Unerwünschte Wirkungen, die Arzneimittel betrafen | 2.233 | 87,6 |
| Unerwünschte Wirkungen, die nicht Arzneimittel, sondern andere Produktgruppen betrafen | 131 | 5,1 |
| Medikationsfehler | 149 | 5,9 |
| Missbrauch | 35 | 1,4 |
Tabelle 2: Anzahl der Verdachtsmeldungen zu Qualitätsmängeln an die AMK im Jahr 2021
| Kategorie der Verdachtsmeldung | Anzahl | Anteil in Prozent |
|---|---|---|
| Meldungen zu Qualitätsmängeln (Verdachtsfälle), gesamt | 5.534 | 100,0 |
| Verpackungsfehler | 2.354 | 42,5 |
| Mechanische Defekte | 1.295 | 23,4 |
| Galenische Mängel | 1.284 | 23,2 |
| Deklarationsmängel | 333 | 6,0 |
| Minderwirkung (mit Verdacht auf Qualitätsmangel) | 178 | 3,2 |
| Manipulation bzw. Fälschung | 16 | 0,3 |
| Sonstige Mängel | 74 | 1,4 |
Im Jahr 2020 erhielt die AMK-Geschäftsstelle insgesamt 8.707 Spontanberichte zu vermuteten Qualitätsmängeln und unerwünschten Wirkungen von Arzneimitteln (siehe Abbildung 1) aus 4.582 verschiedenen (Krankenhaus-)Apotheken.
Dabei ließ sich im vergangenen Jahr ein Zusammenhang zwischen Meldeverhalten und pandemiebedingten Maßnahmen, wie z. B. Kontaktbeschränkungen, erkennen (siehe Abbildung 2). Während das Meldeaufkommen zu Beginn des Jahres 2020 in etwa dem des Vorjahres entsprach, zeichnete sich bereits Ende Februar ein Melderückgang ab, der sich mit den am 13. März beginnenden ersten SARS-CoV2-bedingten „Lockdown“-Maßnahmen verstärkte. In Kalenderwoche 18 (Ende April) erreichte die Melderate das Vorjahresniveau. Im weiteren Verlauf des Jahres 2020 zeichnete sich ab Mitte Juli wieder ein zunehmender Rückgang der wöchentlichen Melderate ab, die mit Beginn des zweiten „Lockdowns“ in Kalenderwoche 50 erneut stark abfiel. Nie zuvor verzeichnete die AMK eine so starke relative Abnahme der Spontanmeldungen in einem Jahr (-19 %), was eindrucksvoll den Wert des unmittelbaren Patientenkontaktes zur Identifizierung von (potentiellen) Arzneimittelrisiken unterstreicht.
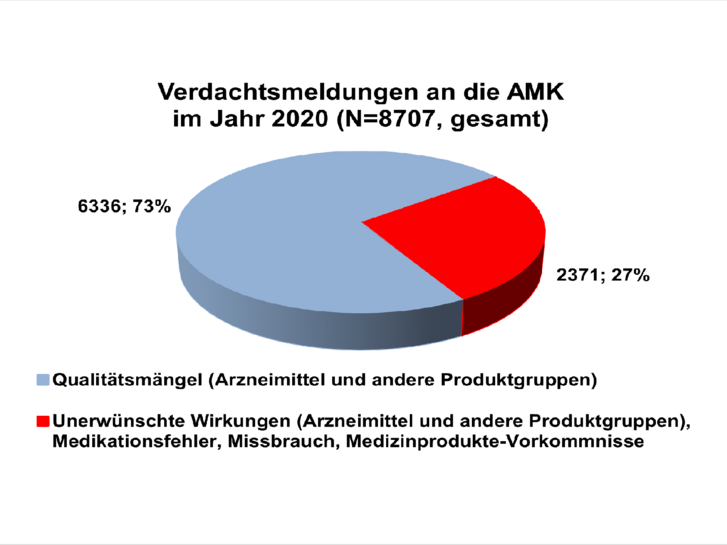
Insgesamt betrafen 97,0 Prozent aller Meldungen im Jahr 2020 Arzneimittel: 7.089 verschreibungspflichtige Arzneimittel inkl. 302 Betäubungsmittel und 1.357 nicht verschreibungspflichtige Arzneimittel. 261 Meldungen bezogen sich auf Lebensmittel inkl. Nahrungsergänzungsmittel, Drogen und Chemikalien sowie weitere Produkte.
Die Anzahl der Spontanberichte zu unerwünschten Wirkungen sank im Vergleich zum Vorjahr um 739 auf insgesamt 2.371 (siehe Tabelle 1). Hierunter fanden sich 809 Meldungen (inklusive Folgeinformationen) zu unerwünschten Arzneimittelwirkungen (UAW), die aufgrund ihrer Klassifikation der Art oder Schwere innerhalb von 15 Tagen (ICH-Guideline E2D) an die zuständigen Bundesoberbehörden weitergeleitet wurden. Meldungen zu UAW machten, ähnlich der Vorjahre, einen Anteil von etwa 27 Prozent aller eingegangenen Berichte aus. Etwa sechs Prozent (133 Meldungen) aller Nebenwirkungsmeldungen bezogen sich auf eine Arzneimittelsubstitution.
Mit 184 Medikationsfehlermeldungen blieb die Anzahl annähernd gleich zum Vorjahr (187). Ihr Anteil innerhalb der UAW-Meldungen stieg jedoch von sechs auf 7,7 Prozent. Ebenso wurden annähernd gleich viele Verdachtsmeldungen zu Arzneimittelmissbrauch erfasst (2020: 56, 2019: 55).
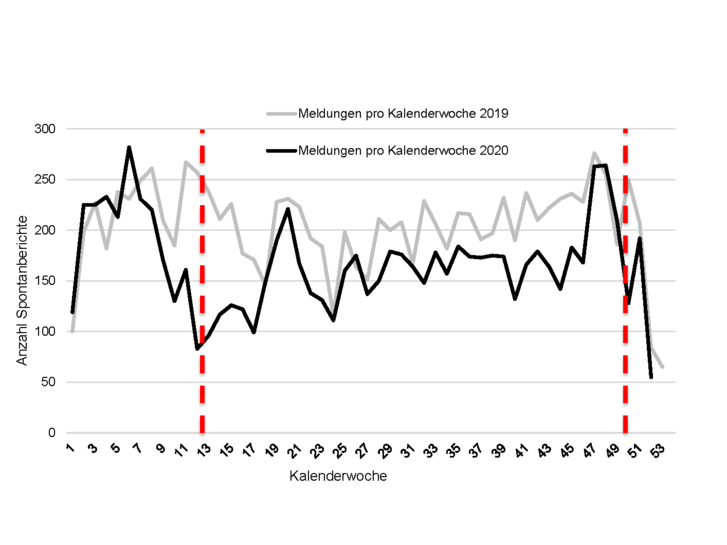
Unter den berichteten Verdachtsmeldungen zu Qualitätsmängeln (6.336 Meldungen) wurden, wie in den Jahren zuvor, am häufigsten Verpackungsfehler gemeldet, gefolgt von mechanischen Defekten, galenischen Mängeln und Deklarationsmängeln (siehe Tabelle 2).
Im Jahr 2020 erhielt die AMK-Geschäftsstelle mit insgesamt zehn Meldungen deutlich weniger Berichte zu vermuteten Manipulationen bzw. Fälschungen (2019: 54). Die zuständige Überwachungsbehörde des betroffenen Zulassungsinhabers wurde in rund 38 Prozent (2.385 Meldungen) aller vermuteten Qualitätsmängel von der AMK benachrichtigt.
Die AMK-Geschäftsstelle erhielt im Jahr 2020 mit insgesamt 1.047 Einsendungen erneut weniger Reklamationsmuster (2019: 1.565). Auch die Zahl an zugesandten Bilddokumentationen sank auf 1.216. Bei rund 20 Prozent der eingesandten Muster wurde eine Untersuchung im Zentrallaboratorium Deutscher Apotheker e. V. veranlasst. In 15 Prozent der Laboruntersuchungen konnte ein Verdachtsfall bestätigt werden.
Die AMK veröffentlichte im Jahr 2020 insgesamt 313 Nachrichten; hierunter 33 Rote-Hand- und Informationsbriefe, 23 Informationen der AMK sowie 46 weitere Nachrichten zu Risiken von Arzneimitteln oder anderen Produkten, die von Behörden, Herstellern und relevanten Institutionen veröffentlicht wurden.
Zudem wurden 170 Chargenrückrufe, 12 Chargenüberprüfungen sowie 27 Rückrufe über die AMK bekanntgegeben und Apotheken zweimal mittels AMK-PHAGRO-Schnellinformationen unmittelbar über dringende Arzneimittelrisiken informiert.
Insgesamt leisteten die Apotheken auch während der SARS-CoV-2-Pandemie einen unverzichtbaren Beitrag zur Erhöhung der Arzneimittel(therapie)sicherheit und damit für die Patientensicherheit. Insgesamt 34 AMK-Nachrichten beruhten auf 372 Meldungen aus 340 Apotheken. Weitere 655 Spontanberichte aus 571 Apotheken führten zur Einleitung korrektiver, risikominimierender Maßnahmen beim betroffenen Hersteller.
Tabelle 1: Anzahl der Verdachtsmeldungen zu unerwünschten Wirkungen (Arzneimittel, andere Produktgruppen), Medikationsfehlern und Missbrauch an die AMK in 2020
| Kategorie | Anzahl | Anteil in Prozent |
|---|---|---|
| Meldungen zu unerwünschten Wirkungen (Verdachtsfälle), gesamt | 2.371 | 100,0 |
| Unerwünschte Wirkungen, die Arzneimittel betrafen | 2.078 | 87,6 |
Unerwünschte Wirkungen, die nicht Arzneimittel, sondern andere Produktgruppen betrafen | 53 | 2,4 |
| Medikationsfehler | 184 | 7,7 |
| Missbrauch | 56 | 2,3 |
Tabelle 2: Anzahl der Verdachtsmeldungen zu Qualitätsmängeln an die AMK in 2020
| Kategorie | Anzahl | Anteil in Prozent |
|---|---|---|
| Meldungen zu Qualitätsmängeln (Verdachtsfälle), gesamt | 6.336 | 100,0 |
| Verpackungsfehler | 2.652 | 41,8 |
| Mechanische Defekte | 1.512 | 23,8 |
| Galenische Mängel | 1.406 | 22,2 |
| Deklarationsmängel | 499 | 7,9 |
| Minderwirkung (mit Verdacht auf Qualitätsmangel) | 176 | 2,8 |
| Manipulation bzw. Fälschung | 10 | 0,2 |
| Sonstige Mängel | 81 | 1,3 |
Im Jahr 2019 erhielt die AMK-Geschäftsstelle insgesamt 10.782 Spontanberichte zu Qualitätsmängeln und unerwünschten Wirkungen von Arzneimitteln (siehe Abbildung) aus 5.274 verschiedenen (Krankenhaus-)Apotheken. Die Anzahl an Meldungen erreichte somit einen erneuten Höchststand.
Insgesamt 97,4 Prozent der Berichte betrafen Arzneimittel: 8.758 verschreibungspflichtige Arzneimittel inkl. 310 Betäubungsmittel und 1.740 nicht verschreibungspflichtige (OTC-)Arzneimittel. Demgegenüber bezogen sich 284 Meldungen unter anderem auf Lebensmittel inkl. Nahrungsergänzungsmittel, Drogen und Chemikalien.
Die Anzahl der Spontanberichte zu unerwünschten Wirkungen stieg im Vergleich zum Vorjahr um 151 auf insgesamt 3.110 (siehe Tabelle 1). Hierunter fanden sich 1.102 Meldungen (inklusive Folgeinformationen) zu unerwünschten Arzneimittelwirkungen (UAW), die aufgrund ihrer Klassifikation der Art oder Schwere innerhalb von 15 Tagen (ICH-Guideline E2D) der zuständigen Bundesoberbehörde weitergeleitet wurden. Meldungen zu UAW machten somit einen Anteil von etwa 29 Prozent aller eingegangenen Berichte aus.
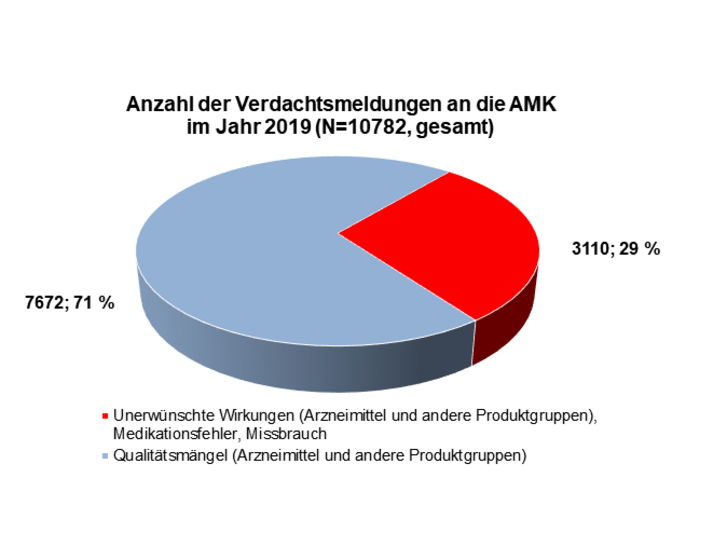
Auch im Jahr 2019 wurden etwa sieben Prozent (213 Meldungen) aller Nebenwirkungsmeldungen im Zusammenhang mit einer Arzneimittelsubstitution gemeldet. Die Anzahl an Medikationsfehlermeldungen stieg im Vergleich zum Vorjahr auf 187 Meldungen (2018: 137); ebenso stieg die Anzahl an Verdachtsmeldungen zu Arzneimittelmissbrauch auf 55 (2018: 45).
Als Qualitätsmängel (7.672 Meldungen) wurden, wie in den Jahren zuvor, am häufigsten Verpackungsfehler gemeldet, gefolgt von galenischen Mängeln, mechanischen Defekten und Deklarationsmängeln (siehe Tabelle 2). Im Jahr 2019 erhielt die AMK-Geschäftsstelle insgesamt 54 Verdachtsmeldungen zu Manipulationen bzw. Fälschungen (2018: 53). Die zuständige Überwachungsbehörde des betroffenen Zulassungsinhabers wurde bei etwa 42 Prozent (3.204 Meldungen) der Qualitätsmangelmeldungen unverzüglich benachrichtigt.
Im Jahr 2019 erhielt die AMK-Geschäftsstelle insgesamt 1.565 Reklamationsmuster; was einem erneuten Rückgang zu den Vorjahren entspricht (2018: 1.802, 2017: 2.181). Demgegenüber stieg die Zahl an eingesandten Bilddokumentationen auf 1.772 weiter an (2018: 1.628, 2017: 1.483). Bei rund 17 Prozent der Muster wurde eine Untersuchung im Zentrallaboratorium Deutscher Apotheker e. V. (ZL) veranlasst. In 14 Prozent der Fälle konnte die Laboruntersuchung den Verdachtsfall bestätigen.
Die AMK veröffentlichte im Jahr 2019 insgesamt 329 Nachrichten (2018: 394): 40 Rote-Hand- und Informationsbriefe, 26 Informationen/Stellungnahmen sowie 40 Nachrichten zu Risiken von Arzneimitteln oder anderen Produkten, die von Behörden, Herstellern und verschiedenen Institutionen veröffentlicht wurden. Weiterhin wurden Apotheken im vergangenen Jahr dreimal mittels AMK-PHAGRO-Schnellinformationen unmittelbar über dringende Arzneimittelrisiken informiert. Zudem wurden 196 Chargenrückrufe, 8 Chargenüberprüfungen und 15 Rückrufe über die AMK bekanntgegeben.
Die meldenden Apotheken leisteten im Jahr 2019 somit erneut einen bedeutsamen Beitrag zur Erhöhung der Arzneimittel(therapie)sicherheit und damit für die Patientensicherheit. Insgesamt 53 AMK-Nachrichten beruhten auf 252 Meldungen aus 234 Apotheken. Weitere 833 Spontanberichte aus 744 Apotheken führten zur Einleitung korrektiver, risikominimierender Maßnahmen durch den betroffenen Hersteller.
Tabelle 1: Anzahl der Verdachtsmeldungen zu unerwünschten Wirkungen (Arzneimittel, Lebensmittel einschließlich NEM, sonstige Produktgruppen), Medikationsfehlern und Missbrauch an die AMK in 2019
| Kategorie | Anzahl | Anteil in Prozent |
|---|---|---|
| Meldungen zu unerwünschten Wirkungen (Verdachtsfälle), gesamt | 3.110 | 100,0 |
| Unerwünschte Wirkungen, die Arzneimittel betrafen | 2.810 | 90,3 |
Unerwünschte Wirkungen, die nicht Arzneimittel, sondern andere Produktgruppen betrafen | 58 | 1,9 |
| Medikationsfehler | 187 | 6,0 |
| Missbrauch | 55 | 1,8 |
Tabelle 2: Anzahl der Verdachtsmeldungen zu Qualitätsmängeln an die AMK in 2019
| Kategorie | Anzahl | Anteil in Prozent |
|---|---|---|
| Meldungen zu Qualitätsmängeln (Verdachtsfälle), gesamt | 7.672 | 100,0 |
| Verpackungsfehler | 3.046 | 39,7 |
| Galenische Mängel | 2.141 | 27,9 |
| Mechanische Defekte | 1.335 | 17,4 |
| Deklarationsmängel | 748 | 9,8 |
| Minderwirkung (mit Verdacht auf Qualitätsmangel) | 233 | 3,0 |
| Manipulation bzw. Fälschung | 54 | 0,7 |
| Sonstige Mängel | 115 | 1,5 |
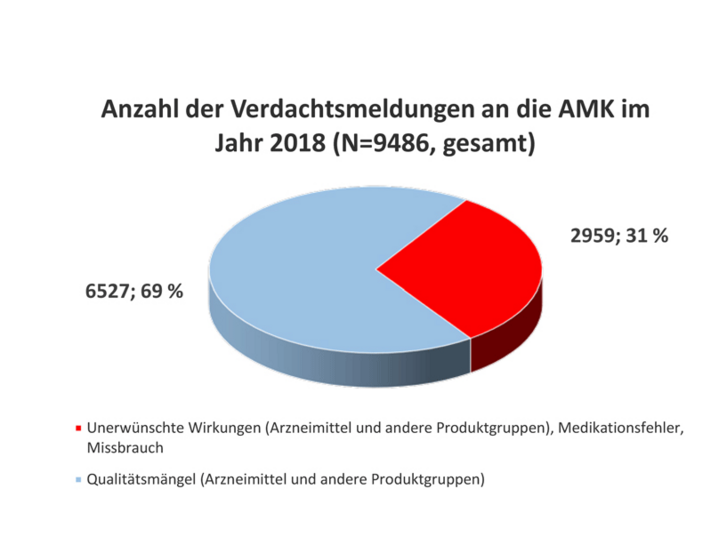
Im Jahr 2018 erhielt die Geschäftsstelle der AMK insgesamt 9486 Spontanberichte zu Qualitätsmängeln und unerwünschten Wirkungen (siehe Abbildung) aus 4846 verschiedenen (Krankenhaus-)Apotheken. Somit erhöhte sich die Anzahl der Meldungen seit dem Jahr 2015 kontinuierlich und erreichte nun einen neuen Höchststand. Rund 97 Prozent der Meldungen betrafen Arzneimittel (7329 verschreibungspflichtige und 1839 OTC-Arzneimittel). Zu anderen Produktgruppen wurde seltener berichtet: 282 Meldungen zu Medizinprodukten (nicht in der Gesamtzahl von 9486 berücksichtigt) und 167 Meldungen zu Lebensmitteln, 110 Meldungen hiervon betrafen Nahrungsergänzungsmittel (NEM). Zu pflanzlichen Drogen und Chemikalien erhielt die AMK 84 Meldungen.
Die Anzahl der Spontanberichte zu unerwünschten Wirkungen stieg im Vergleich zum Vorjahr um 257 Meldungen auf insgesamt 2959 (siehe Tabelle 1). Dies entspricht einem Anteil von etwa 31 Prozent aller eingegangener Berichte (siehe Abbildung). Hierunter fanden sich 1027 Meldungen (inklusive Folgeinformationen) zu unerwünschten Arzneimittelwirkungen (UAW), die aufgrund ihrer Klassifikation der Art oder Schwere innerhalb von 15 Tagen (ICH-Guideline E2D) der zuständigen Bundesoberbehörde weitergeleitet wurden. Seit dem 1. Mai 2018 übermittelt die Geschäftsstelle der AMK sämtliche an sie gemeldete UAW-Verdachtsfälle nicht mehr zusätzlich an die pharmazeutischen Unternehmen. Somit soll der doppelten Erfassung innerhalb des europäischen Spontanberichtssystems bei stetig wachsendem Meldeaufkommen entgegengewirkt und das Risiko einer Erzeugung von Fall-Duplikaten verringert werden (siehe Pharm. Ztg. 2018 Nr 18, Seite 97).
Im letzten Jahr wurden etwa sieben Prozent (198 Meldungen) aller UAW-Meldungen im Zusammenhang mit einer Arzneimittelsubstitution gemeldet. Die Zahl zu Verdachtsmeldungen zu Medikationsfehlern nahm mit 137 Meldungen im Vergleich zum Vorjahr ab (2017: 192); ebenso wie Verdachtsmeldungen zu Arzneimittelmissbrauch (2018: 45, 2017: 50).
Als Qualitätsmängel (6527 Meldungen) wurden, wie in den Jahren zuvor, am häufigsten Verpackungsfehler gemeldet, gefolgt von galenischen Mängeln, mechanischen Defekten und Deklarationsmängeln (siehe Tabelle 2). Im Jahr 2018 erhielt die Geschäftsstelle der AMK insgesamt 53 Verdachtsmeldungen zu Manipulationen bzw. Fälschungen (2017: 57). Die zuständige Überwachungsbehörde des betroffenen Zulassungsinhabers wurde bei etwa 40 Prozent (2570 Meldungen) der Verdachtsmeldungen zu Qualitätsmängeln unverzüglich benachrichtigt.
Insgesamt erhielt die AMK-Geschäftsstelle 1802 Reklamationsmuster; dies entspricht einem erneuten Rückgang zum Vorjahr (2017: 2181). Hingegen stieg die Zahl an eingesandten Bilddokumentationen auf 1628 (2017: 1483). Bei rund neun Prozent der Muster wurde eine Untersuchung im Zentrallaboratorium Deutscher Apotheker e. V. (ZL) veranlasst. Insgesamt 17 Verdachtsfälle wurden bestätigt.
Die AMK veröffentlichte im Jahr 2018 insgesamt 394 AMK-Nachrichten (2017: 321): 75 Rote-Hand- und Informationsbriefe, 28 Informationen/Stellungnahmen der AMK sowie 38 Nachrichten zu Risiken von Arzneimitteln oder anderen Produkten, die von Behörden und verschiedenen Institutionen veröffentlicht wurden. Weiterhin wurden Apotheken im vergangenen Jahr zweimal mittels AMK-PHAGRO- Schnellinformationen unmittelbar und direkt über dringende Arzneimittelrisiken informiert. Zudem wurden 194 Chargenrückrufe, 12 Chargenüberprüfungen und 45 Rückrufe über die AMK bekanntgegeben.
Die meldenden Apotheken leisteten im Jahr 2018 erneut einen bedeutsamen Beitrag zur Erhöhung der Arzneimittel(therapie)sicherheit und damit für die Patientensicherheit. Insgesamt 43 AMK-Nachrichten beruhten auf 181 Meldungen aus 147 Apotheken. Weitere 660 Spontanberichte aus 593 Apotheken führten zur Einleitung korrektiver, risikominimierender Maßnahmen bei dem betroffenen Hersteller.
Die Geschäftsstelle der AMK erhielt im Jahr 2018 über 3100 Anfragen per Fax, E-Mail oder Telefon, darunter 51 komplexe Anfragen zur Arzneimittel(therapie)sicherheit, zu Arzneimittelrisiken und zur Bewertung der Bedenklichkeit von Rezepturarzneimitteln (Ausgangsstoffe).
| Kategorie | Anzahl | Prozent |
|---|---|---|
| Meldungen zu unerwünschten Wirkungen (Verdachtsfälle) und andere Meldungen, gesamt | 2959 | 100,0 |
| Unerwünschte Wirkungen, die Arzneimittel betrafen | 2695 | 91,1 |
| Unerwünschte Wirkungen, die nicht Arzneimittel, sondern andere Produktgruppen betrafen | 82 | 2,8 |
| Medikationsfehler | 137 | 4,6 |
| Missbrauch | 45 | 1,5 |
Tabelle 1: Anzahl der Verdachtsmeldungen zu unerwünschten Wirkungen (Arzneimittel, Lebensmittel (einschließlich NEM), sonstige Produkte), Medikationsfehlern und Missbrauch an die AMK-Geschäftsstelle in 2018
| Kategorie | Anzahl | Prozent |
|---|---|---|
| Meldungen zu Qualitätsmängeln (Verdachtsfälle), gesamt | 6527 | 100,0 |
| Verpackungsfehler | 2883 | 44,2 |
| Galenische Mängel | 1403 | 21,6 |
| Mechanische Defekte | 1268 | 19,4 |
| Deklarationsmängel | 628 | 9,6 |
| Minderwirkung (mit Verdacht auf Qualitätsmangel) | 172 | 2,6 |
| Manipulation bzw. Fälschung | 53 | 0,8 |
| Sonstige Mängel | 119 | 1,8 |
Tabelle 2: Anzahl der Verdachtsmeldungen zu Qualitätsmängeln an die AMK-Geschäftsstelle in 2018
Im Jahr 2017 erhielt die Geschäftsstelle der AMK insgesamt 9084 Spontanberichte zu Qualitätsmängeln und unerwünschten Wirkungen (s. Abbildung) aus 4816 verschiedenen Apotheken. Nach dem bisherigen Höchststand im Jahr 2016 wurde somit erneut eine Steigerung der Meldungen verzeichnet. Erstmals erhielt die AMK über 9000 Verdachtsmeldungen zu Arzneimittelrisiken aus Apotheken. Rund 96 Prozent der Meldungen betrafen Arzneimittel (6762 verschreibungspflichtige und 1990 OTC-Arzneimittel). Zu pflanzlichen Drogen und Chemikalien erhielt die AMK 84 Meldungen. Andere Produktgruppen wurden, wie von der AMK aufgerufen, seltener berichtet: Medizinprodukte (279; nicht in der Gesamtzahl von 9084 berücksichtigt) und Lebensmittel (165), zu denen die Nahrungsergänzungsmittel zählen (121).
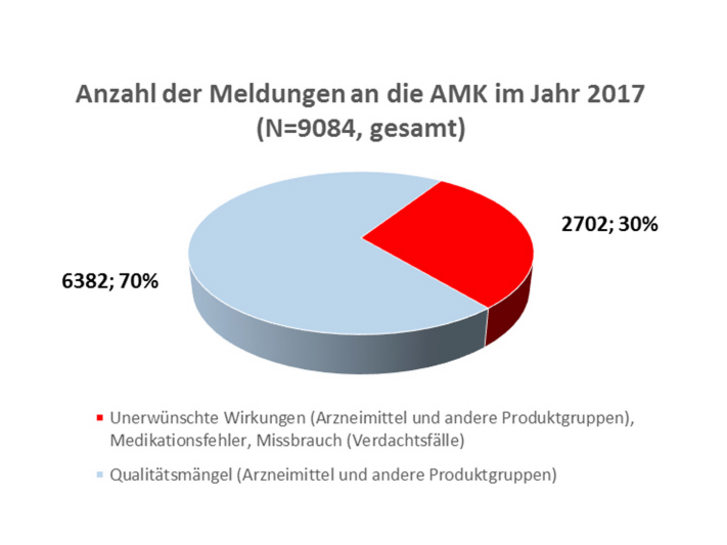
Die Zahl der Spontanberichte zu unerwünschten Wirkungen stieg im Vergleich zum Vorjahr um 62 Meldungen auf insgesamt 2702 (s. Tabelle 1); dies entspricht erneut etwa 30 Prozent (s. Abbildung) aller eingegangenen Berichte. Hierunter fanden sich 889 (Initial-)Meldungen (inklusive Folgeinformationen) zu unerwünschten Arzneimittelwirkungen (UAW), die aufgrund Ihrer Klassifikation der Art oder Schwere innerhalb von 15 Tagen (ICH-Guideline E2D) der zuständigen Bundesoberbehörde sowie an den pharmazeutischen Unternehmer weitergeleitet wurden. Zudem wurden im Vergleich zu 2016 (151 Meldungen) wieder mehr UAW berichtet, die im Zusammenhang mit einer Arzneimittelsubstitution standen: 188 Meldungen. Für das Jahr 2017 entspricht dies etwa sieben Prozent der Gesamtzahl an Spontanberichte zu unerwünschten Wirkungen. Zu Medikationsfehlern gingen insgesamt 192 Meldungen ein. Hingegen wurden Vorkommnisse bei Medizinprodukten von der AMK nicht mehr erfasst. Aufgrund der Änderung der Medizinprodukte-Sicherheitsplanverordnung (MPSV) sind Apotheken seit dem 1. Januar 2017 verpflichtet, Vorkommnisse zu Medizinprodukten ausschließlich an das BfArM weiterzuleiten (siehe Pharm. Ztg. 2016 Nr. 45, Seite 107).
Als Qualitätsmängel (6382 Meldungen) wurden, wie in den Jahren zuvor, am häufigsten Verpackungsfehler gemeldet, gefolgt von galenischen Mängeln, mechanischen Defekten und Deklarationsfehlern (s. Tabelle 2). Bei Verdachtsmeldungen zu Manipulationen bzw. Fälschungen war ein Anstieg zu beobachten. In 2017 stieg die Zahl auf insgesamt 57 Meldungen (2016: 14).
Insgesamt erhielt die AMK-Geschäftsstelle 2181 Reklamationsmuster; dies entspricht einem erneuten Rückgang zum Vorjahr (2016: 2326); zeitgleich stieg die Anzahl an Bilddokumentationen auf 1483 (2016: 1081). Bei rund 10 Prozent der Muster wurde eine Untersuchung im Zentrallaboratorium Deutscher Apotheker e. V. (ZL) veranlasst. 32 Verdachtsfälle (14 Prozent) wurden bestätigt. Bei etwa jedem dritten Spontanbericht zu Qualitätsmängeln (2311) benachrichtigte die AMK unverzüglich die zuständige Überwachungsbehörde des betroffenen Zulassungsinhabers.
Im Jahr 2017 veröffentlichte die AMK insgesamt 321 AMK-Nachrichten (2016: 298). Hierunter fanden sich 28 Rote-Hand- und Informationsbriefe, 21 Informationen/Stellungnahmen der AMK sowie 54 Nachrichten über Risiken von Arzneimitteln und anderen Produkten, die von Behörden und verschiedenen Institutionen veröffentlicht wurden. Weiterhin wurden 161 Chargenrückrufe, 19 Chargenüberprüfungen und 31 Rückrufe über die AMK bekanntgegeben.
14,6 Prozent der AMK-Nachrichten im Jahr 2017 stützten sich auf insgesamt 146 Meldungen aus 141 Apotheken. Weitere 902 Spontanberichte aus 776 Apotheken führten zur Einleitung korrektiver, risikominimierender Maßnahmen bei dem betroffenen Hersteller. Insofern leisteten die Apotheken im Jahr 2017 einen bedeutsamen Beitrag zur Erhöhung der Arzneimittel(therapie)sicherheit und damit für die Patientensicherheit.
Die AMK bittet Sie, auch weiterhin Beobachtungen zu UAW sowie Hersteller-verursachten Qualitätsmängeln (auch Verdachtsfälle) möglichst vollständig und vorzugsweise mittels Online-Formular an die Geschäftsstelle der AMK (www.arzneimittelkommission.de) zu übermitteln. Beachten Sie bitte: Melden Sie Qualitätsmängel, wenn die Annahme gerechtfertigt ist, dass diese vom Hersteller verursacht worden sind, auch an die für Ihre Apotheke zuständige örtliche Behörde.
Die Geschäftsstelle der AMK erhielt im Jahr 2017 etwa 53 komplexe Anfragen zur Arzneimittel(therapie)sicherheit, zur Bewertung von Rezepturarzneimitteln hinsichtlich Bedenklichkeit nach Paragraf 5 AMG und zu unerwünschten Arzneimittelwirkungen. Dazu wurden weitere 2819 Anfragen per Fax, E-Mail oder Telefon an die AMK gerichtet.
Fragen zu Arzneimittelrisiken und Spontanmeldungen/Einsendungen beantworten Ihnen die Mitarbeiterinnen und Mitarbeiter der AMK-Geschäftsstelle gern
(www.arzneimittelkommission.de).
| Kategorie | Anzahl | Prozent |
|---|---|---|
| Meldungen zu unerwünschten Wirkungen (Verdachtsfälle) und andere Meldungen, gesamt | 2702 | 100,0 |
| Unerwünschte Wirkungen, die Arzneimittel betrafen | 2407 | 89,1 |
| Unerwünschte Wirkungen, die nicht Arzneimittel, sondern andere Produktgruppen betrafen | 53 | 1,9 |
| Medikationsfehler | 192 | 7,1 |
| Missbrauch | 50 | 1,9 |
Tabelle 1: Anzahl der Verdachtsmeldungen zu unerwünschten Wirkungen (Arzneimittel, Lebensmittel (einschließlich NEM), sonstige Produkte), Medikationsfehlern und Missbrauch (Verdachtsfälle) an die AMK-Geschäftsstelle in 2017
| Kategorie | Anzahl | Prozent |
|---|---|---|
| Meldungen zu Qualitätsmängeln (Verdachtsfälle), gesamt | 6382 | 100,0 |
| Verpackungsfehler | 2780 | 43,6 |
| Galenische Mängel | 1494 | 23,4 |
| Mechanische Defekte | 1095 | 17,2 |
| Deklarationsmängel | 623 | 9,7 |
| Minderwirkung (mit Verdacht auf Qualitätsmangel) | 234 | 3,7 |
| Manipulation bzw. Fälschung | 57 | 0,9 |
| Sonstige Mängel | 98 | 1,5 |
Tabelle 2: Anzahl der Meldungen zu Qualitätsmängeln (Verdachtsfälle) an die AMK-Geschäftsstelle in 2017
Im Jahr 2016 erhielt die Geschäftsstelle der AMK insgesamt 8891 Spontanberichte zu Qualitätsmängeln und unerwünschten Wirkungen (Abbildung) aus 4584 verschiedenen Apotheken. Verglichen mit der Anzahl an Meldungen seit 1993 stellt dies den bisherigen Höchststand dar. Wie im Vorjahr betrafen rund 90 Prozent der Meldungen Arzneimittel (6132 verschreibungspflichtige Arzneimittel und 1907 OTC-Arzneimittel). Zu anderen Produktgruppen wurde seltener berichtet: Medizinprodukte (461), Lebensmittel (201), zu denen die Nahrungsergänzungsmittel zählen (143) und pflanzliche Drogen und Chemikalien (75).
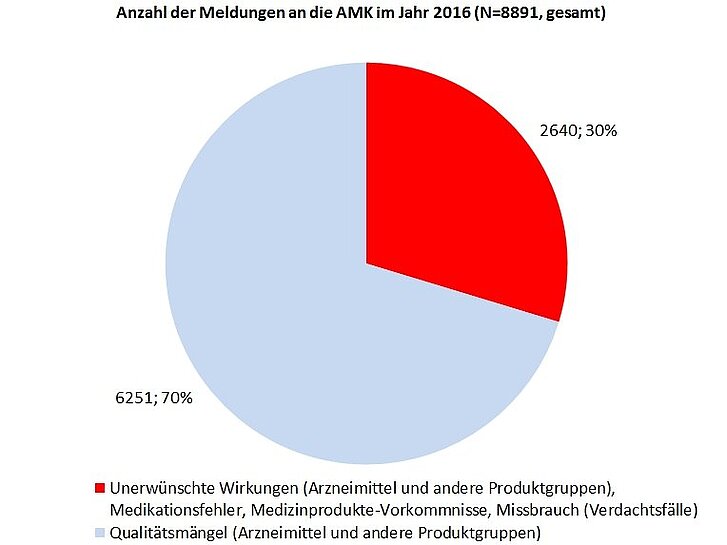
Die Zahl der Spontanberichte zu unerwünschten Wirkungen fiel im Vergleich zum Vorjahr um 36 Meldungen auf insgesamt 2640 (Tabelle 1), was nunmehr 30 Prozent (Abbildung) aller eingegangenen Berichte entspricht. Hierunter fanden sich 662 Meldungen zu unerwünschten Arzneimittelwirkungen (UAW), die aufgrund ihrer Klassifikation der Art und/oder Schwere innerhalb von 15 Tagen (ICH-Guideline E2D) an die zuständige Bundesoberbehörde sowie an den pharmazeutischen Unternehmer weitergeleitet wurden. Dagegen wurden im Vergleich zum Jahr 2015 mit 151 Meldungen rund 34 Prozent weniger UAW berichtet, die im Zusammenhang mit einer Arzneimittelsubstitution standen. Zu Medikationsfehlern gingen insgesamt 134 Meldungen ein. Vorkommnisse bei Medizinprodukten wurden insgesamt 62 mal an die AMK gemeldet.
Als Qualitätsmängel wurden, wie in den Vorjahren, am häufigsten Verpackungsfehler gemeldet, gefolgt von galenischen Mängeln, mechanischen Defekten und Deklarationsfehlern (Tabelle 2). Bei Verdachtsmeldungen zu Arzneimittel-Manipulationen/-Fälschungen war in den letzten Jahren ein Rückgang zu beobachten. In 2016 blieb die Zahl nahezu unverändert zum Vorjahr bei insgesamt 14 Meldungen (2015: 15) und somit erneut auf niedrigem Niveau. Insgesamt erhielt die AMK-Geschäftsstelle 2326 Reklamationsmuster, was einem erneuten Rückgang zum Vorjahr entspricht (2015: 2569); zeitgleich stieg die Anzahl an Bilddokumentationen auf über 1000 (2015: 817). Bei 7 Prozent der Muster wurde eine Untersuchung im Zentrallaboratorium Deutscher Apotheker e. V. (ZL) veranlasst. 20 Verdachtsfälle (12,5 Prozent) wurden bestätigt. Bei etwa jedem vierten Spontanbericht zu Qualitätsmängeln (1589) benachrichtigte die AMK unverzüglich die örtlich zuständige Überwachungsbehörde des betroffenen Zulassungsinhabers.
Im Jahr 2016 veröffentlichte die AMK insgesamt 298 AMK-Nachrichten (2015: 331). Hierunter waren 20 Rote-Hand- und Informationsbriefe, 16 Informationen/Stellungnahmen der AMK sowie 30 Nachrichten über Risiken von Arzneimitteln und anderen Produkten, die von Behörden und verschiedenen Institutionen veröffentlicht wurden. Weiterhin wurden 170 Chargenrückrufe, 10 Chargenüberprüfungen und 35 Rückrufe über die AMK bekanntgegeben.
Etwa 11 Prozent der AMK-Nachrichten im Jahr 2016 stützten sich auf 76 Spontanberichte aus insgesamt 75 Apotheken. Weitere 733 Berichte aus 647 Apotheken führten zur Einleitung korrektiver risikominimierender Maßnahmen bei dem betroffenen Hersteller. Somit leisteten die Apotheken auch im vergangenen Jahr einen bedeutsamen Beitrag zur Erhöhung der Arzneimittel(therapie)sicherheit. Die AMK bittet Sie daher, auch weiterhin Beobachtungen zu unerwünschten Arzneimittelwirkungen sowie vom Hersteller verursachte Qualitätsmängel (auch Verdachtsfälle) möglichst vollständig und vorzugsweise mittels Online-Formular an die Geschäftsstelle der AMK (www.arzneimittelkommission.de) zu übermitteln. Beachten Sie bitte: Melden Sie Qualitätsmängel, wenn die Annahme gerechtfertigt ist, dass diese vom Hersteller verursacht worden sind, auch an die für Ihre Apotheke zuständige regionale Behörde.
Bitte beachten Sie außerdem: Aufgrund der Änderung der Medizinprodukte-Sicherheitsplanverordnung (MPSV) sind Apotheken seit dem 1. Januar 2017 verpflichtet, Vorkommnisse zu Medizinprodukten ausschließlich an das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) weiterzuleiten (siehe Pharm. Ztg. Nr. 3 vom 19. Januar 2017, Seite 105).
Die Geschäftsstelle der AMK erhielt im Jahr 2016 ca. 45 komplexe Anfragen zur Arzneimittel(therapie)sicherheit, zur Bewertung von Rezepturarzneimitteln hinsichtlich Bedenklichkeit nach Paragraf 5 AMG und zu unerwünschten Arzneimittelwirkungen. Dazu wurden weitere 2565 Anfragen per Fax, E-Mail oder Telefon an die AMK gerichtet.
Ihre Fragen zu Arzneimittelrisiken und Meldungen/Einsendungen beantworten Ihnen weiterhin gern die Mitarbeiterinnen und Mitarbeiter der AMK-Geschäftsstelle (www.arzneimittelkommission.de).
| Kategorie | Anzahl | Prozent |
|---|---|---|
| Meldungen zu unerwünschten Wirkungen (Verdachtsfälle) und andere Meldungen, gesamt | 2640 | 100,0 |
| Unerwünschte Wirkungen, die Arzneimittel betrafen ("UAW-Verdachtsfälle") | 2250 | 85,2 |
| Unerwünschte Wirkungen, die nicht Arzneimittel, sondern andere Produktgruppen betrafen (Verdachtsfälle) | 134 | 5,1 |
| Medikationsfehler | 134 | 5,1 |
| Missbrauch (Verdachtsfälle) | 60 | 2,3 |
| Medizinprodukte-Vorkommnisse | 62 | 2,3 |
Tabelle 1: Anzahl der Meldungen zu unerwünschten Wirkungen (Arzneimittel, Lebensmittel (einschließlich NEM), sonstige Produkte), Medikationsfehlern, Vorkommnissen bei Medizinprodukten und Missbrauch (Verdachtsfälle)
| Kategorie | Anzahl | Prozent |
|---|---|---|
| Meldungen zu Qualitätsmängeln (Verdachtsfälle), gesamt | 6251 | 100,0 |
| Verpackungsfehler | 2640 | 42,2 |
| Galenische Mängel | 1547 | 24,8 |
| Mechanische Defekte | 1060 | 17,0 |
| Deklarationsmängel | 725 | 11,6 |
| Minderwirkung (mit Verdacht auf Qualitätsmangel) | 170 | 2,7 |
| Manipulation/AM-Fälschung | 14 | 0,2 |
| Sonstige Mängel | 95 | 1,5 |
Tabelle 2: Anzahl der Meldungen zu Qualitätsmängeln an die AMK-Geschäftsstelle in 2016
Im Jahr 2015 gingen bei der Geschäftsstelle der AMK insgesamt 8409 Spontanberichte zu Qualitätsmängeln und unerwünschten Wirkungen aus 4434 verschiedenen Apotheken ein (Abbildung). Im Vergleich zur Meldehöchstzahl in 2014 war ein Rückgang um zirka 5 Prozent festzustellen.
Rund 90 Prozent der Meldungen betrafen Arzneimittel (5831 verschreibungspflichtige Arzneimittel und 1783 OTC-Arzneimittel). Zu anderen Produktgruppen wurde weitaus seltener gemeldet: Medizinprodukte (476), Lebensmittel, zu denen die Nahrungsergänzungsmittel zählen (145), und pflanzliche Drogen und Chemikalien (82).
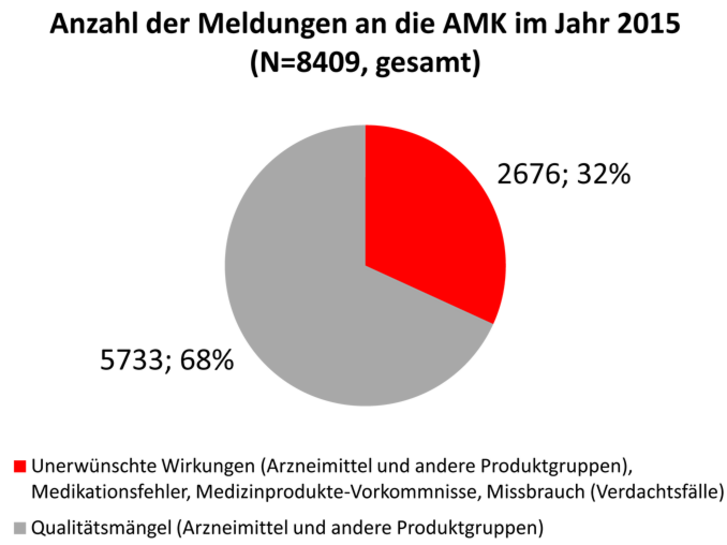
Die Zahl der Meldungen zu unerwünschten Wirkungen stieg im Vergleich zum Vorjahr um 60 (Bitte beachten Sie die Korrekturmeldung vom 11. Februar 2016) auf insgesamt 2676 (Tabelle 1). Damit betrug ihr Anteil an allen eingegangenen Meldungen nunmehr 32 Prozent (Abbildung). Unter diesen befanden sich 324 Meldungen zu schwerwiegenden unerwünschten Arzneimittelwirkungen (UAW) sowie nahezu unverändert zum letzten Jahr 228 UAW, die aufgrund einer Arzneimittelsubstitution gemeldet wurden. Zu Medikationsfehlern gingen insgesamt 328 Meldungen ein und somit deutlich mehr als im Jahr zuvor (2014: 107). Vorkommnisse bei Medizinprodukten wurden insgesamt 34 mal (2014: 49) an die AMK gemeldet.
Als Qualitätsmängel wurden, wie in den Vorjahren, am häufigsten Verpackungsfehler gemeldet, gefolgt von galenischen Mängeln, mechanischen Defekten und Deklarationsfehlern (Tabelle 2). Bei Meldungen zu Arzneimittel-Manipulationen/-Fälschungen war wie in den letzten Jahren ein Rückgang zu beobachten. Insgesamt gingen 2569 Einsendungen mit Reklamationsmustern ein. Damit war ein Rückgang der Muster-Einsendungen wie in den Vorjahren (2013: 3322, 2014: 2907) festzustellen. Bei 6 Prozent der Muster wurde eine Untersuchung im Zentrallaboratorium Deutscher Apotheker e. V. (ZL) veranlasst. Davon wurden 24 Verdachtsfälle (15,5 Prozent) bestätigt.
In 1070 Fällen (19 Prozent) benachrichtigte die AMK unverzüglich die örtlich zuständige Überwachungsbehörde des betroffenen Zulassungsinhabers, da der Verdacht bestand, dass Qualitätsmängel vorlagen, die vom Hersteller verursacht worden waren.
Im Jahr 2015 veröffentlichte die AMK insgesamt 331 AMK-Nachrichten (Vorjahr: 417). Darunter waren 21 Rote-Hand- und Informationsbriefe sowie 20 Informationen/Stellungnahmen der AMK. Desweiteren informierte die AMK in 54 Nachrichten über Risiken von Arzneimitteln und anderen Produkten, die von Behörden und verschiedenen Institutionen veröffentlicht wurden. Darüber hinaus wurden 184 Chargenrückrufe, 10 Chargenüberprüfungen und 22 Rückrufe bekannt gegeben. Im Jahr 2015 gingen etwa 15 Prozent aller AMK-Nachrichten auf 259 Meldungen von 208 Apotheken zurück. Weitere 601 Meldungen aus 527 Apotheken führten zur Einleitung korrektiver risikominimierender Maßnahmen bei Herstellern. Damit haben die Apotheken auch im vergangenen Jahr einen bedeutsamen Beitrag zu einer erhöhten Arzneimittelsicherheit geleistet. Bitte melden Sie auch weiterhin Ihre Beobachtungen zu unerwünschten Arzneimittelwirkungen sowie vom Hersteller verursachte Qualitätsmängel (auch Verdachtsfälle) möglichst vollständig und vorzugsweise mittels Online-Formular an die AMK-Geschäftsstelle (www.arzneimittelkommission.de). Beachten Sie bitte: Melden Sie Qualitätsmängel, wenn die Annahme gerechtfertigt ist, dass diese vom Hersteller verursacht worden sind. In diesen Fällen ist auch die für Ihre Apotheke zuständige regionale Behörde zu benachrichtigen.
Über 98 komplexe Anfragen zur Arzneimittel(therapie)sicherheit, zur Bewertung von Rezepturarzneimitteln hinsichtlich Bedenklichkeit nach Paragraf 5 AMG und zu unerwünschten Arzneimittelwirkungen erhielt die Geschäftsstelle in 2015. Dazu wurden weitere 2560 Anfragen per Fax, E-Mail oder Telefon an die AMK gerichte
Ihre Fragen zu Arzneimittelrisiken und Meldungen/Einsendungen beantworten Ihnen weiterhin gern die Mitarbeiterinnen und Mitarbeiter der AMK-Geschäftsstelle (www.arzneimittelkommission.de).
| Kategorie | Anzahl | Prozent |
|---|---|---|
| Meldungen zu unerwünschten Wirkungen (Verdachtsfälle) und andere Meldungen, gesamt | 2676 | 100,0 |
| Unerwünschte Wirkungen, die Arzneimittel betrafen ("UAW-Verdachtsfälle") | 2114 | 79,0 |
| Unerwünschte Wirkungen, die nicht Arzneimittel, sondern andere Produktgruppen betrafen (Verdachtsfälle) | 141 | 5,3 |
| Medikationsfehler | 328 | 12,2 |
| Missbrauch (Verdachtsfälle) | 59 | 2,2 |
| Medizinprodukte-Vorkommnisse | 34 | 1,3 |
Tabelle 1: Anzahl der Meldungen zu unerwünschten Wirkungen (Arzneimittel, Lebensmittel (einschließlich NEM), sonstige Produkte), Medikationsfehlern, Vorkommnissen bei Medizinprodukten, Missbrauch (Verdachtsfälle) an die AMK-Geschäftsstelle in 2015
| Kategorie | Anzahl | Prozent |
|---|---|---|
| Meldungen zu Qualitätsmängeln (Verdachtsfälle), gesamt | 5733 | 100,0 |
| Verpackungsfehler | 2446 | 42,7 |
| Galenische Mängel | 1413 | 24,6 |
| Deklarationsmängel | 699 | 12,2 |
| Mechanische Defekte | 788 | 13,7 |
| Minderwirkung (mit Verdacht auf Qualitätsmangel) | 173 | 3,0 |
| Manipulation/AM-Fälschung | 15 | 0,3 |
| Sonstige Mängel | 199 | 3,5 |
Tabelle 2: Anzahl der Meldungen zu Qualitätsmängeln an die AMK-Geschäftsstelle in 2015
Die AMK hat im Jahr 2014 insgesamt 8832 Spontanberichte zu Qualitätsmängeln und unerwünschten Wirkungen von 4797 verschiedenen Apotheken erhalten (siehe Tabelle). Die Meldehöchstzahl aus dem Jahr 2012 wurde somit um 373 Meldungen übertroffen. Die Meldungen betrafen hauptsächlich Arzneimittel (6251 verschreibungspflichtige Arzneimittel und 1824 OTC-Arzneimittel) und Medizinprodukte (399), aber auch andere Produktgruppen, wie zum Beispiel Diätetika, Nahrungsergänzungsmittel, pflanzliche Drogen und Chemikalien.
Der Anteil der Meldungen zu unerwünschten Wirkungen ist im Vergleich zum Vorjahr auf 30 Prozent gestiegen. Darunter befanden sich insgesamt 300 Meldungen zu schwerwiegenden unerwünschten Arzneimittelwirkungen (UAW) und unter anderem 229 UAW, die aufgrund einer Arzneimittelsubstitution gemeldet wurden. Zu Medikationsfehlern, die überwiegend erfolgreich mit den Bundesoberbehörden bearbeitet wurden, gingen in 2014 nur 107 Meldungen ein (Vorjahr: 235). Vorkommnisse von Medizinprodukten wurden insgesamt 49 mal gemeldet.
Als Qualitätsmängel wurden, wie in den Jahren zuvor, am häufigsten Verpackungsfehler gemeldet, gefolgt von galenischen Mängeln, mechanischen Defekten und Deklarationsfehlern. Bei den Meldungen zu Arzneimittel-Manipulationen/-Fälschungen war ein Rückgang im Vergleich zum Vorjahr (2013: 81 Meldungen) zu verzeichnen.
Bei 7 Prozent der insgesamt 2907 Einsendungen an die AMK wurde eine Untersuchung im Zentrallaboratorium Deutscher Apotheker e.V. (ZL) vorgenommen. Davon konnten 55 Fälle (26,5 Prozent) bestätigt werden. In 1422 Fällen musste die AMK die örtlich zuständige Überwachungsbehörde benachrichtigen.
Über 115 komplexe Anfragen zur Arzneimittel(therapie)sicherheit gingen in 2014 in der AMK ein. Zumeist handelte es sich um Fragen zur Bewertung von Rezepturarzneimitteln im Hinblick auf Bedenklichkeit nach § 5 AMG. Dazu kamen weitere 2935 Anfragen per Fax, E-Mail oder Telefon an die AMK.
Im Jahr 2014 veröffentlichte die AMK 19 AMK-Nachrichten mehr als in 2013 - insgesamt 417. Darunter waren 25 Rote-Hand- und Informationsbriefe sowie 23 Informationen/Stellungnahmen der AMK. Darüber hinaus wurden 192 Chargenrückrufe, 7 Chargenüberprüfungen, 44 Rückrufe und weitere 25 Herstellerinformationen publiziert. Die AMK versendete im Jahr 2014 sechs dringende Rückrufe mittels AMK-PHAGRO-Schnellinformation. 11 Prozent aller AMK-Nachrichten gingen auf 259 Meldungen von 195 Apotheken zurück. Zur Einleitung korrektiver risikominimierender Maßnahmen beim Hersteller trugen weitere 478 Meldungen bei, die die AMK von 437 Apotheken erhalten hatte.
Bitte senden Sie Ihre Beobachtungen (auch Verdachtsfälle) zu unerwünschten Wirkungen sowie Qualitätsmängeln möglichst vollständig und vorzugsweise mittels Online-Formular an die AMK (www.arzneimittelkommission.de), denn Ihre Meldungen leisten einen wichtigen Beitrag zur Erhöhung der Sicherheit von Arzneimitteln und Medizinprodukten. Beachten Sie bitte: Qualitätsmängel sollen auch der jeweils zuständigen regionalen Behörde gemeldet werden.
| Kategorie | N | Prozent |
|---|---|---|
| Qualitätsmängel | 6216 | 100 |
| Verpackungsfehler | 2587 | 41,6 |
| Galenische Mängel | 1624 | 26,1 |
| Deklarationsmängel | 797 | 12,8 |
| Mechanische Defekte | 778 | 12,5 |
| Minderwirkung (mit Verdacht auf Qualitätsmangel) | 194 | 3,1 |
| Manipulation/AM-Fälschung | 50 | 0,8 |
| Sonstige Mängel | 186 | 3,0 |
| Unerwünschte Wirkungen und andere | 2616 | 100 |
| Unerwünschte Wirkungen | 2415 | 92,4 |
| davon Arzneimittel betreffend (UAW-Verdachtsfälle) | 2291 | 87,6 |
| Medikationsfehler | 107 | 4,0 |
| Missbrauch (Verdachtsfälle) | 45 | 1,7 |
| Medizinprodukte-Vorkommnisse | 49 | 1,9 |
Tabelle: Auswertung der Meldungen an die Arzneimittelkommission der Deutschen Apotheker (AMK) in 2014. N = Anzahl der Meldungen
Kontakt
Arzneimittelkommission der Deutschen Apotheker (AMK)
Heidestraße 7
10557 Berlin
Telefax: 030 40004-553
Telefon: 030 40004-552
E-Mail: amk(at)arzneimittelkommission.de